통합 검색
통합 검색
연구배경
만성 바이러스 감염 및 종양 생성과 T세포
최근의 통계에 의하면 전 세계적으로 4천만 명, 3억5천만 명, 1억7천만 명의 사람들이 각각 HIV, HBV, HCV에 감염이 된 상태로 살아가고 있다. 이와 같이 만성 바이러스에 감염된 사람들은 첫째, 만성 감염 및 암 등의 만성 질환으로 발전할 위험성을 가지고 있으며, 둘째, 자신의 건강에 위협을 줄 뿐만 아니라 바이러스 보균자로서 다른 비감염군의 사람들에게 감염을 초래할 수 있고, 셋째, 다른 병원균에 대해 매우 취약한 면역 방어 시스템을 가짐으로써 연속 감염의 위험성 까지 내포한다고 말할 수 있다.
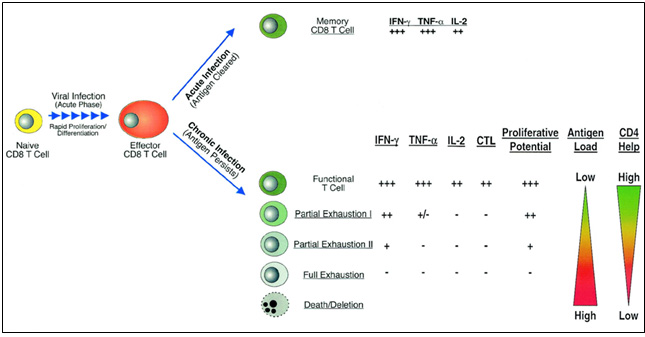
현재까지 만성 바이러스 감염에 대한 숙주 면역 시스템의 변화에 관한 연구들은 주로 후천 면역 반응 (adaptive immune response)에 집중되어 왔다. 급성 바이러스 감염과 선천 면역 반응 (innate immune response)과의 연결 고리에 대한 연구가 현재는 활발하게 진행되고 있지만, 아직까지 만성 바이러스 감염이난 종양 생성 같은 지속적 항원 존재 하에서 생성되는 선천 면역 반응과의 연결 고리에 대해서는 연구가 미미한 상태이다. 후천 면역 반응에 대한 연구는 크게 "항원 특이적인 B 세포 분화에 의해 생성되는 항체 분야"와 "T 세포 분화에 의해 생성되는 면역 기억 T cell 분야”로 크게 나눠지는데, 만성 바이러스 감염이나 종양 생성의 경우에는 감염된 세포들이나 종양세포를 직접 살상하는 세포 독성 T cell (cytotoxic T cell; CTL)에 대한 연구들이 많이 진행되어 왔다.
급성 바이러스 감염 후와 비교하여 만성 바이러스 감염이나 종양 생성 후에는 숙주 면역 반응이 판이하게 다른 양상으로 나타나게 되는 것으로 알려져 있는데 특히, 세포 독성 T 세포의 분화가 제대로 일어나지 않게 된다. 만성 바이러스 감염이나 종양 생성의 초기에는 항원 특이적인 세포 독성 T 세포의 생성이 유도되는 것으로 알려져 있지만 여러 가지 이유로 인해 숙주 내에 바이러스나 종양이 제어되지 못하여 남아있게 되면서 결과적으로 T 세포는 바이러스나 종양 항원에 지속적으로 노출된다. 이러한 환경에서는 사이토카인 (cytokine)이나 케모카인 (chemokine) 같은 면역 조절 물질들의 분비도 제대로 조절되지 못하고 또한 이러한 환경 (지속적인 항원 + 과다한 염증 유도 면역 조절 물질)에 노출된 T 세포는 내부적으로 면역 억제 신호가 유도되어 결과적으로 세포 독성 T 세포의 기능을 상실하게 된다. 즉, 급성 바이러스 감염 후에 생성된 바이러스 특이적인 T 세포는 분화 과정을 거쳐서 "메모리 T 세포 (memory T cell)"가 되는 반면, HIV, HBV, HCV 와 같은 만성 바이러스 감염이나 종양 생성 후에 생성된 항원 특이적인 T 세포는 본연의 기능을 상실한 "피폐된 T 세포 (exhausted T cell)"로 분화된다.
다양한 기능의 수지상세포
수지상세포는 외부 병원균이 숙주 내로 침입하게 되었을 때 가장 먼저 반응하는 세포들 중의 하나로 알려져 있다. 수지상세포에서 발현되는 Toll like receptor들은 서로 다른 패턴의 병원균에 반응하여 선천 면역 반응을 유도하게 되는데 이와 같은 기능 이외에도 외부 병원균의 항원을 세포 표면의 주 적합 복합체(major histocompatibility complex)에 제시함으로써 T 세포 및 B 세포를 자극하거나 증식하는데 가장 중요한 역할을 하는 세포로 알려져 있다. 특히 수지상세포와 T 세포 사이의 상호작용은 T 세포의 분화와 증식의 시발점이 되기 때문에 수지상세포의 세포 면역학적 특성은 후천 면역 반응의 결과를 결정하는 가장 중요한 요소로 알려져 있다. 수지상세포 표면에 발현되는 주 적합 복합체는 T 세포 표면의 T 세포 수용체 (T cell receptor, TCR)에 T 세포 자극 신호를 매개하게 되며, 보조자극분자 (co-stimulatory molecule)와 함께 T 세포의 분화를 최적화시킨다. 반면, 수지상세포에 발현되는 보조억제분자 (co-inhibitory molecule)는 T 세포 분화를 억제하는 역할을 수행하는 것으로 보고되었다.
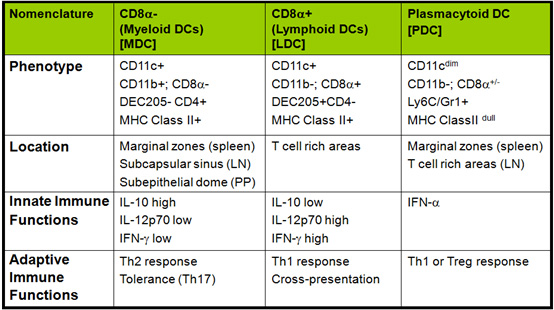
현재까지의 보고에 의하면 수지상세포는 기능상의 분류에 의해 크게 세 가지 다른 종류로 분류할 수 있다. 세 가지 다른 종류의 수지상세포 (myeloid, lymphoid, plasmacytoid DCs)는 아래의 표에서 제시된 것처럼 기능 및 위치에서 서로 다른 양상을 나타내는 것으로 알려져 있지만 다양한 바이러스 감염이나 종양 생성 하에서 각 수지상세포의 역할에 대해서는 자세하게 연구되어 있지 않다. 특히 급성 및 만성 바이러스 감염이나 종양 생성 시에 수지상세포의 분화 및 각 수지상세포의 역할에 대해서는 연구가 전무한 상태이다.

컨텐츠 불러오는 중




